我们非常重视您的个人隐私,当您访问我们的网站时,请同意使用所有的cookie。有关个人数据处理的更多信息可访问我们的《法律声明及隐私政策》
-
产品中心


-
配液应用


-
储液与运输应用


-
流体管理


-
细胞培养与微生物发酵


-
QuaCell®CHO LeAd Medium
-
QuaCell® LeTrans Medium and Feed Medium
-
QuaCell® CellBest Basal Medium & 007 Feed Medium
-
LeCulti® 细胞透气培养瓶
-
LePhinix® EZG台式生物反应器
-
LeProlif™ Disk 片状载体
-
LeProlif™ Sphere 球状微载体
-
LePhinix®一次性生物反应器
-
LeSeidon™即用型注射用水
-
LeKrius®一次性生物反应袋
-
LeKrius®一次性无菌取样袋
-
LeThenea®一次性冻存袋
-
摇摆式混匀系统
-
LeCouple™pH/DO 电极套管组件
-
-
分液与分装


-
制剂灌装


-
过滤与纯化


-
LePurValid®验证服务


-
关联品牌


-

联系电话:
021-37635888
点击解锁乐纯生物 LeKrius 硬核“膜”力!手把手教你如何保障一次性系统的安全性!

2021-11-25

随着生物制药的蓬勃发展,生产用一次性系统在制药领域的应用越来越广泛,从上游细胞培养到下游纯化,再到原液储存、半成品配制,直至终端灌装。一次性系统灵活可塑,不仅可以避免交叉污染、降低清洁验证的成本,还可以缩短周期、加快药品开发与上市的进程。
一次性系统虽然好处多多,但制药企业在选用时却非常谨慎。在实际应用过程中,制药企业一方面认可一次性技术的诸多优势,另一方面部分企业会担心在使用和变更的过程中,法规合规性方面出现问题。所以如何更好把控一次性系统的风险评估和相关风险控制,毫无疑问是一大考验。
针对现有客户的痛点,乐纯生物手把手教你如何保障一次性系统的安全性!

完全符合cGMP和生物制药的相关法规和要求
根据各国GMP及其相关法规的要求:
“
生产设备不得对药品质量产生任何不利影响。与药品直接接触的生产设备表面应当平整、光洁、易清洗或消毒、耐腐蚀,不得与药品发生化学反应、吸附药品或向药品中释放物质。”
“在完成可提取物或者浸出物试验后,应针可提取物或浸出物的种类和含量,结合药品最终剂型中的浓度、剂量大小、给药时间、给药途径等对结果进行安全性评估,以评估可提取物和浸出物是否存在安全风险。
因此,除了满足制药企业的工艺需求,一次性系统在与工艺流体接触过程中:
☑ 需要保证终产品的安全性,即不析出超过安全性阈值的毒性物质
☑ 需要保证工艺效能,即不影响细胞生长
☑ 需要保证终产品质量,即不影响终产品的稳定性、活性等
完善的验证文件支持
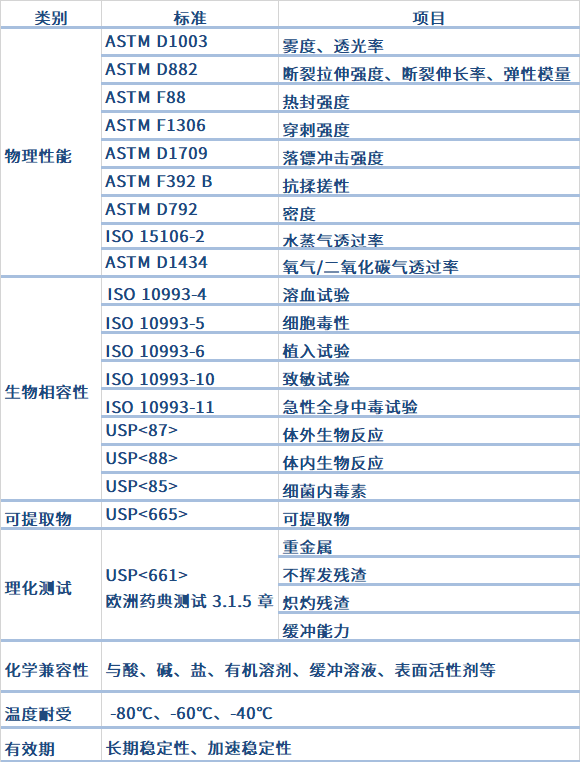
按照质量源于设计(QbD)的理念,一次性系统需要考虑的所有安全性问题,真正有效的控制,应该放在前端--也就是材质的选择与研发阶段。一次性系统的材质选择应经过充分地研究,满足相关法规要求并具有高性能的特点,研发产品需满足生物工艺应用并保证其安全性。
乐纯生物自研膜材LeKrius,遵循相关法规要求进行完善的验证测试,并且可以覆盖全生物工艺阶段的一次性使用系统的膜材性能需求。
下表为乐纯生物LeKrius 膜在研发阶段已完成的检测项目。